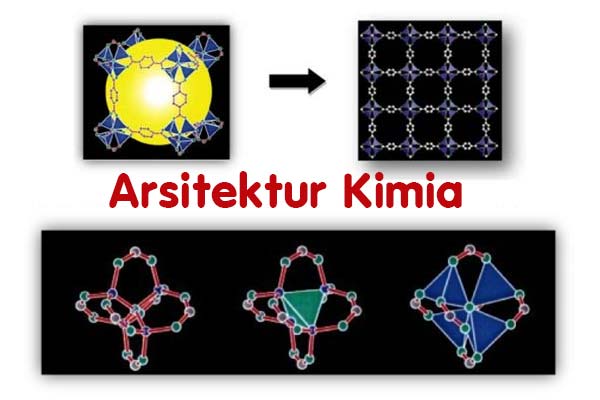
Arsitektur kimia merupakan bagaimana merancang molekul yang artistik, dipelajari ikatan/ interaksi antara logam dengan ligan (senyawa organik), bagaimana stabilitas termal senyawa itu, dan dikaitkan dengan segala potensi yang mungkin diaplikasikan. Arsitektur kimia bisa diistilahkan sebagai bidang ilmu rekayasa kristal (crystal engineering).
Berbicara mengenai unsur-unsur golongan transisi sangatlah mengasyikkan. Terutama unsur transisi yang dikelompokkan sebagai blok–d di dalam sistem periodik unsur mempunyai banyak sekali keistimewaan apabila ditelaah dari konfigurasi elektronnya. Berdasarkan konfigurasi elektron ini bisa dipelajari juga sifat fisisnya, antara lain tren dalam panjang diameter atomnya, standar entalpi maupun potensial reduksi, sifat magnetnya, dan penampakannya yang berwarna-warni.
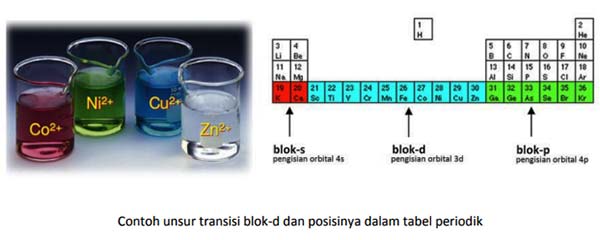
Pertama-tama, mari kita pelajari mengapa unsur-unsur transisi ini menunjukkan warna warni yang sangat menarik. Unsur transisi blok-d memiliki orbital 3d yang masih kosong atau yang baru yang diisi sebagian oleh elektron, sehingga memungkinkan transisi elektron dari satu orbital ke orbital lainnya. Inilah yang menyebabkan mereka berwarna-warni. Pada gambar larutan ion beberapa unsur transisi di atas, kita bisa lihat warna Co2+ ungu kemerahan, Ni2+ hijau, Cu2+ biru, dan Zn2+ bening. Kita coba uraikan pengisian orbital untuk Co2+ dan Zn2+ yang warnanya kontras satu sama lain.
Konfigurasi elektron Co2+ (melepas 2 elektron) adalah:
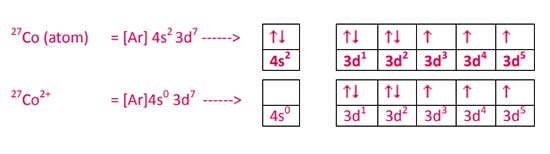
Sedangkan konfigurasi elektron untuk Zn2+ adalah:
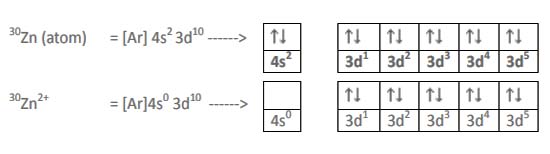
Di sini bisa kita perhatikan orbital d pada Co2+ masih belum penuh, sedangkan pada Zn2+ sudah terisi penuh. Perbedaan pengisian orbital ini menghasilkan warna yang berbeda. Transisi elektron akan menyerap panjang gelombang komplementer dari warna yang bersesuaian
Selanjutnya, apa untungnya orbital-orbital kosong maupun orbital yang belum penuh elektronnya tersebut? Dengan masih adanya tempat untuk elektron itu berpotensi bagi logam-logam transisi untuk berikatan dengan senyawa yang disebut ligan (ligand).
Dalam hal ini ligan bersifat sebagai basa Lewis (Lewis base), yang berperan sebagai donor elektron, karena dalam hal ini ligan mempunyai pasangan electron bebas untuk disumbangkan, sedangkan logam transisi menyediakan orbital kosong berperan sebagai asam Lewis. Ikatan seperti inilah yang dinamakan ikatan kovalen koordinasi.
Sebagai contohnya adalah kompleks [Ag(NH3)2]2SO4, di mana Ag berperan sebagai logam pusat (Lewis acid) sementara NH3 dengan N yang mempunyai sepasang elektron bebas berperan sebagai basa lewis. Sedangkan SO4 2- berperan untuk mengkompensasi muatan total dalam senyawa kompleks tersebut.
Reaksi pembentukan kompleks [Ag(NH3)2] + adalah sebagai berikut:
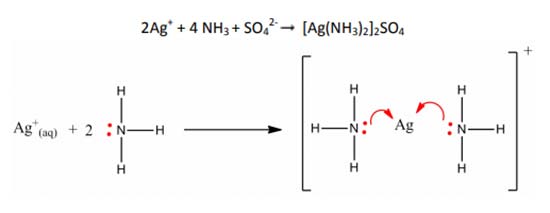
Contoh sederhana ini menghasilkan molekul kompleks [Ag(NH3)2] + yang bisa ditebak geometrinya, yaitu linear (sudut NH3-Ag-NH3 adalah 180°C). Kaitannya dengan konfigurasi elektron adalah hibridisasi orbital yang terbentuk, yaitu untuk linear biasanya diformulasikan sp. Beberapa geometri lainnya misalnya seperti sp3 (untuk tetrahedral), d 2 sp3 (oktahedral), serta dsp2 (segi empat planar).
Apa sebenarnya manfaat pengetahuan dasar geometri seperti ini dipelajari? Coba perhatikan struktur molekul tiga dimensi (3D) dari MOF-5 (Metal Organic Frameworks) berikut.
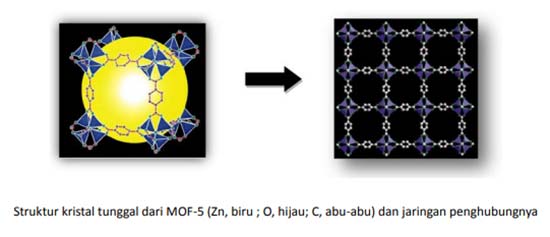
MOF, yang disebut juga polimer koordinasi, pada dasarnya dimulai dari konsep sederhana. Desain ligan dipilih yang mempunyai pasangan elektron bebas di kedua ujungnya (sisi depan dan belakang) yang bisa bersifat asam seperti gugus fungsi karboksilat, maupun yang bersifat netral seperti turunan piridine.
Ligan ini kemudian disambungkan dengan logam-logam transisi yang menyediakan orbital kosong untuk berkoordinasi, sehingga membentuk semacam jaringan (network). Pada sisi-sisi kubus ada semacam cluster (dalam kasus ini adalah asosiasi antara logam-logam dengan oksigen), yaitu berupa Zn4O yang membentuk struktur tetrahedron.
Masing-masing Zn2+ sisinya berikatan dengan 6 grup karboksilat membentuk konstruksi oktahedral. Begitulah seterusnya pada masing-masing unit, sehingga membentuk jaringan yang berupa polimer koordinasi. Untuk lebih jelasnya perhatikan gambar di bawah ini.
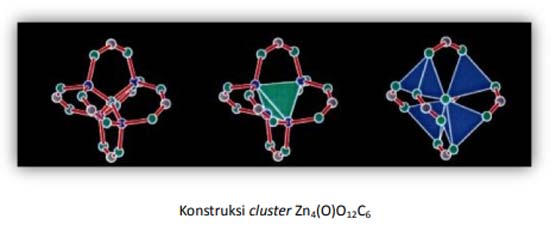
Cluster Zn4(O)O12C6, digambarkan di sebelah kiri dalam bentuk model ball and stick (Zn, biru; O, hijau; C, abu), gambar tengah sebenarnya sama yaitu Zn4(O), tapi digambarkan dalam bentuk tetrahedron (berupa warna hijau). Dan di sebelah kanan juga sama, hanya saja tetrahedral Zn4O digambarkan dalam warna biru.
Di sinilah letak seninya geometri dalam kimia, dan bisa diistilahkan sebagai bidang ilmu rekayasa kristal (crystal engineering) atau bisa disebut sebagai arsitektur kimia. Bagaimana merancang molekul yang artistik, dipelajari ikatan/ interaksi antara logam dengan ligan (senyawa organik), bagaimana stabilitas termal senyawa itu, dan dikaitkan dengan segala potensi yang mungkin diaplikasikan.
Untuk MOFs sendiri banyak sekali aplikasi yang bisa diterapkan. Isu paling panas adalah sebagai penyimpan hidrogen, yang merupakan bahan fuel cell yang dalam pemakaiannya bebas polusi karena hanya mempunyai produk samping berupa air (H2 + ½O2 Energi + H2O).
Selain itu MOFs digunakan sebagai katalis heterogen karena sifat logamnya yang dapat berperan sebagai asam lewis, atau karena karena modifikasi ligan dalam pori sehingga bisa menciptakan sisi aktif untuk katalis. MOFs juga bisa digunakan dalam proses penyaluran obat dalam sel tubuh, sebagai sensor, magnet, dan masih banyak lagi.
Bahan bacaan
- C. E. Housecroft and A.G. Sharpe, Inorganic Chemistry 3· rd edition, Pearson Prentice Hall (2008).
- H. Li, M. Eddaoudi, M. O’Keeffe and O. M. Yaghi, Nature 402, 276 (1999).
Sumber: Witri Wahyu Lestari, “Arsitektur Molekul Kompleks” Majalah guru1000.
Arsitektur Kimia Molekul Kompleks







